Le patch Lidoderm, un patch analgésique topique, a reçu l'approbation de la FDA en 1999.Cette approbation a marqué son introduction en tant que dispositif médical pour le soulagement de la douleur, en s'appuyant sur la lidocaïne pour fournir un traitement localisé.La conception et l'efficacité du patch répondent aux normes réglementaires requises pour de tels produits, ce qui garantit sa disponibilité pour les patients qui ont besoin de solutions non invasives pour le traitement de la douleur.
Explication des points clés :
-
Année d'approbation de la FDA:
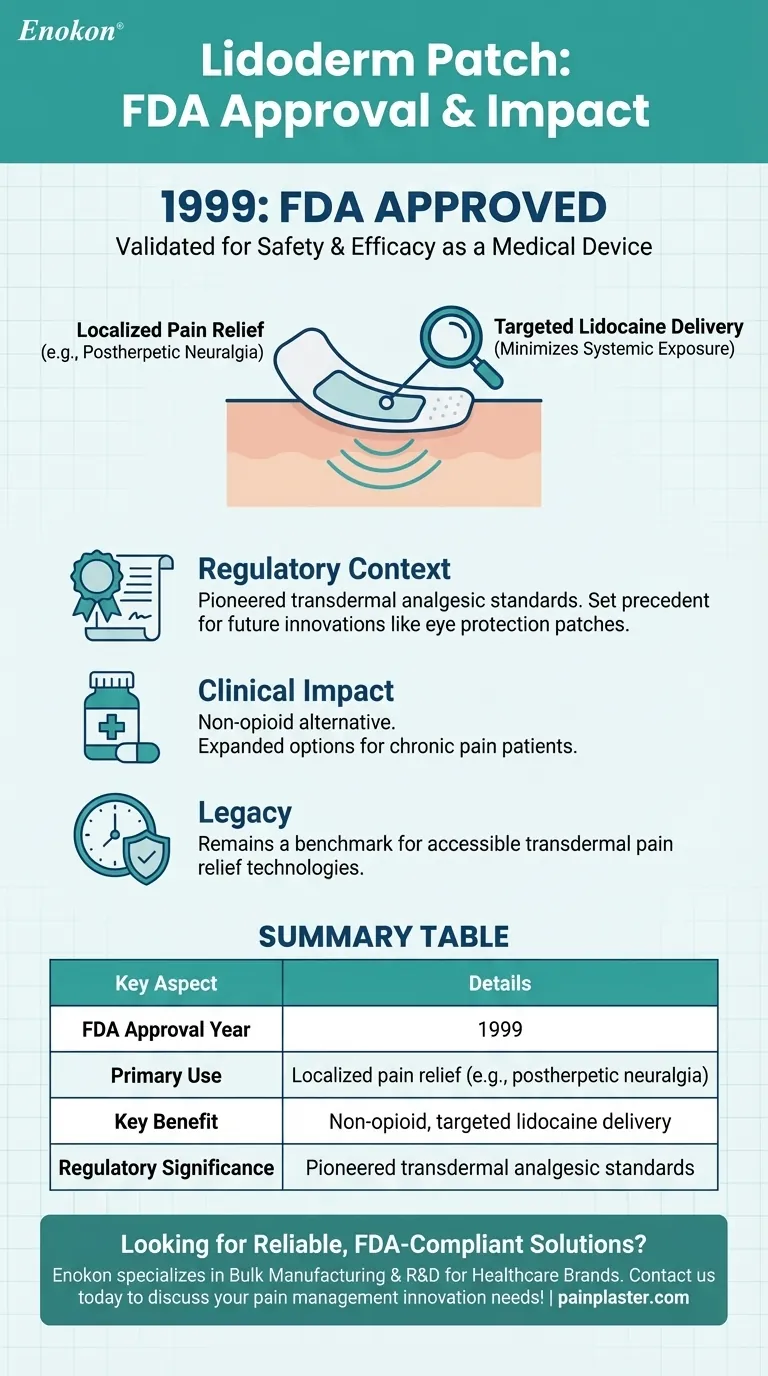
- Le patch Lidoderm a été approuvé par la Food and Drug Administration (FDA) des États-Unis en 1999 .Cette étape a permis de valider l'innocuité et l'efficacité du patch pour une utilisation clinique.
- Le processus d'approbation a impliqué des tests rigoureux pour s'assurer que le patch répondait aux normes d'administration efficace de la lidocaïne sans effets secondaires systémiques.
-
Objectif et conception:
- Le patch est conçu pour fournir un soulagement localisé de la douleur, en particulier pour des conditions telles que la névralgie post-zostérienne (douleur liée au zona).
- Son support adhésif permet une administration ciblée de la lidocaïne, minimisant ainsi l'exposition à d'autres zones du corps.
-
Contexte réglementaire:
- L'approbation de la FDA en 1999 a placé le patch Lidoderm parmi les premières innovations en matière d'analgésie topique.
- Il a créé un précédent pour des produits similaires, notamment le patch de protection des yeux qui ont ensuite été utilisés pour différentes applications thérapeutiques.
-
Impact clinique:
- Le patch offre une alternative non opioïde pour le traitement de la douleur, en accord avec l'importance croissante accordée à la réduction de l'utilisation des médicaments systémiques.
- Son approbation a élargi les options pour les patients souffrant de douleurs chroniques, en particulier ceux qui sont sensibles aux médicaments oraux.
Le patch Lidoderm reste une référence en matière de soulagement de la douleur par voie transdermique, reflétant le rôle de la FDA dans l'avancement des technologies de santé accessibles.
Tableau récapitulatif :
| Aspect clé | Détails |
|---|---|
| Année d'approbation de la FDA | 1999 |
| Utilisation primaire | Soulagement de la douleur localisée (par exemple, névralgie post-zostérienne) |
| Principaux avantages | Administration ciblée et non opioïde de lidocaïne avec une exposition systémique minimale |
| Importance réglementaire | Normes pionnières en matière d'analgésiques transdermiques |
Vous recherchez des solutions analgésiques transdermiques fiables et conformes aux normes de la FDA ? Enokon est spécialisée dans la fabrication en vrac de patchs analgésiques de haute qualité et dans la recherche et le développement sur mesure pour les marques de soins de santé. Contactez nous dès aujourd'hui pour discuter de vos besoins et tirer parti de notre expertise en matière d'innovation dans la gestion de la douleur !
Guide Visuel
Produits associés
- Patch de protection des yeux à base de plantes Patch pour les yeux
- Patch antidouleur en hydrogel de lidocaïne pour le soulagement de la douleur
- Patch oculaire Hydra Gel Health Care
- Patch anti-douleur Icy Hot Menthol Medicine
- Patch contre la toux et la douleur de l'asthme pour adultes et enfants
Les gens demandent aussi
- En combien de temps peut-on constater les résultats de l'utilisation des patchs sous les yeux ?Éclaircissement instantané et avantages à long terme
- Les patchs pour le contour des yeux doivent-ils être appliqués avant ou après la crème hydratante ?Optimisez votre routine de soins de la peau
- Comment l'utilisation de patchs pour les yeux peut-elle contribuer à une routine de soins de la peau ?Hydratation et relaxation
- Comment les patchs pour les yeux améliorent-ils l'efficacité des crèmes pour les yeux ?Améliorez votre routine de soins des yeux
- Quand faut-il consulter un médecin au sujet de l'utilisation de ce patch ?Principales consignes de sécurité
















