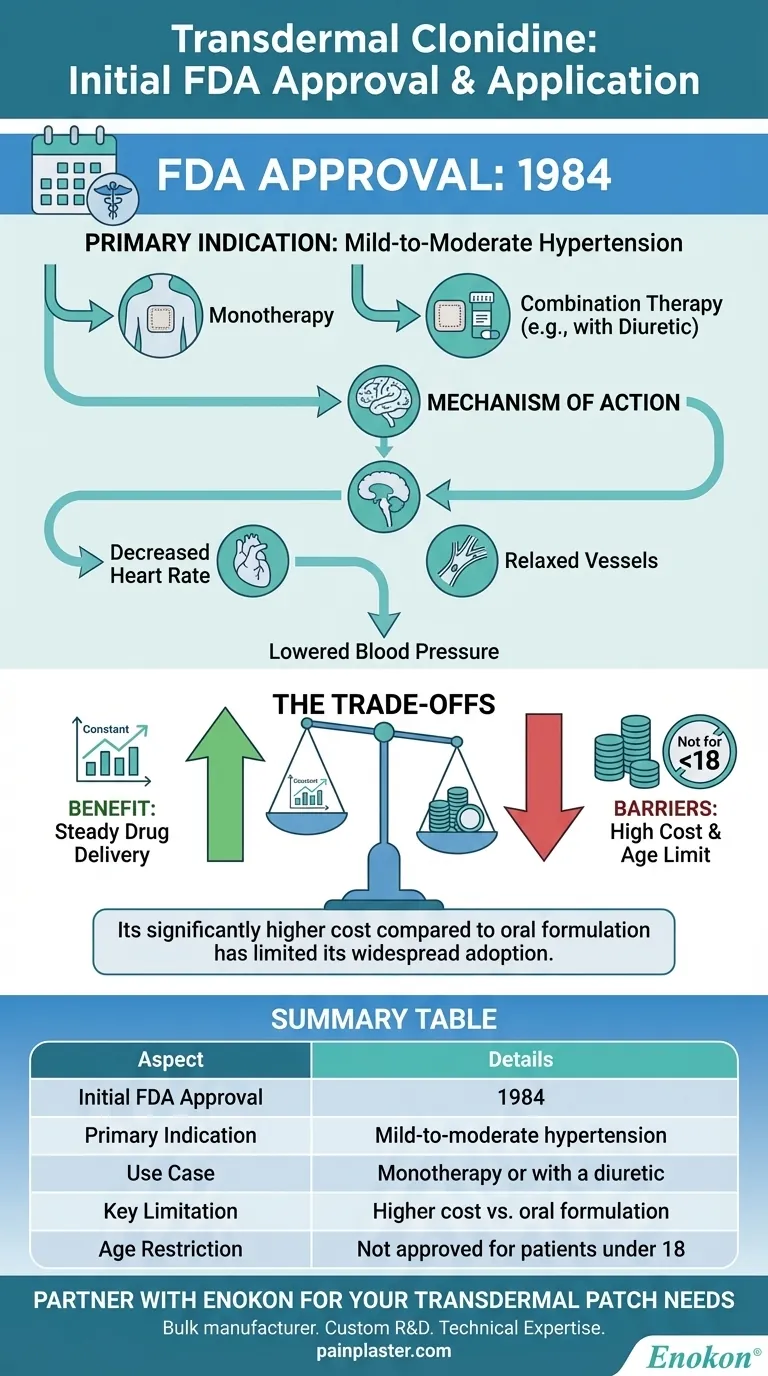
La clonidine transdermique a été initialement approuvée par la Food and Drug Administration (FDA) des États-Unis en 1984 pour le traitement de l'hypertension légère à modérée, soit en tant que traitement autonome, soit en association avec un diurétique.Cette autorisation a marqué l'introduction d'une nouvelle méthode d'administration de la clonidine, tirant parti de sa capacité à abaisser la tension artérielle par le biais de mécanismes alpha-agonistes centraux.Le timbre transdermique offrait des avantages tels qu'une libération soutenue du médicament et une meilleure observance du traitement par le patient, ce qui constituait à l'époque une avancée significative dans la prise en charge de l'hypertension.
Explication des points clés :
-
Approbation initiale de la FDA (1984)
- Le patch transdermique de clonidine a reçu l'approbation de la FDA en 1984, spécifiquement pour le traitement de l'hypertension légère à modérée.
- Cette autorisation a validé son efficacité en tant que monothérapie ou en tant qu'adjuvant aux diurétiques, répondant ainsi à un besoin critique d'options antihypertensives à longue durée d'action.
-
Indication principale :Hypertension
-
Le patch a été conçu pour assurer une administration continue de clonidine, réduisant ainsi la pression artérielle en
- diminuant la fréquence cardiaque
- Détendre les vaisseaux sanguins pour améliorer la circulation.
- Sa classification en tant qu'agent hypotenseur agent hypotenseur alpha-agoniste à action centrale souligne son mécanisme d'action dans le tronc cérébral pour moduler l'écoulement sympathique.
-
Le patch a été conçu pour assurer une administration continue de clonidine, réduisant ainsi la pression artérielle en
-
Avantages de l'administration transdermique
- Contrairement aux formulations orales, le patch garantit des niveaux de médicament stables, minimisant les fluctuations entre les pics et les creux.
- La réduction de la fréquence d'administration (par exemple, application hebdomadaire) améliore l'observance, en particulier pour les maladies chroniques telles que l'hypertension.
-
Restrictions liées à l'âge
- Notamment, la forme transdermique n'a pas été approuvée pour les patients de moins de 18 ans, en raison des données limitées sur la sécurité dans les populations pédiatriques à l'époque.
-
Contexte historique
- L'autorisation de 1984 représentait une innovation en matière d'administration de médicaments, s'inscrivant dans une tendance plus large vers des thérapies non orales pour les maladies cardiovasculaires.
- Il complétait la clonidine orale existante, offrant une alternative aux patients ayant des problèmes de tolérance gastro-intestinale.
Le patch transdermique de clonidine reste un témoignage de la façon dont les systèmes d'administration de médicaments ciblés peuvent transformer la gestion des maladies chroniques - en optimisant discrètement la thérapie grâce à une science à fleur de peau.
Tableau récapitulatif :
| Aspect clé | Détails |
|---|---|
| Année d'approbation de la FDA | 1984 |
| Indication principale | Hypertension légère à modérée (en monothérapie ou en association avec des diurétiques) |
| Mécanisme d'action | Alpha-agoniste à action centrale, réduit l'écoulement sympathique. |
| Principaux avantages | Libération régulière du médicament, amélioration de l'observance, dosage hebdomadaire |
| Restrictions liées à l'âge | Non approuvé pour les patients de moins de 18 ans |
Besoin de solutions transdermiques fiables pour l'hypertension ou la douleur chronique ?
Enokon est spécialisé dans les patchs transdermiques de haute qualité, combinant des décennies d'expertise avec une R&D personnalisable pour les marques pharmaceutiques et les distributeurs.
Contactez nous dès aujourd'hui pour discuter de votre projet.
pour discuter de votre projet - innovons ensemble !
Guide Visuel
Produits associés
- Patchs anti-douleur à chaleur infrarouge lointaine Patchs transdermiques
- Patchs chauffants anti-douleur pour les crampes menstruelles
- Patches de soulagement de la chaleur profonde par infrarouge lointain Patches médicamenteux de soulagement de la douleur
- Patch de protection des yeux à base de plantes Patch pour les yeux
- Patch anti-douleur au gel de menthol
Les gens demandent aussi
- Comment les patchs de chaleur profonde soulagent-ils la douleur ?Une thérapie par la chaleur ciblée pour un confort durable
- Les patchs thermiques sont-ils sans danger pour toutes les parties du corps ?Lignes directrices pour une utilisation sûre
- Comment fonctionne le patch dorsal de soulagement de la douleur par la chaleur profonde ?Soulagement de la douleur sans médicament grâce à la chaleur thérapeutique
- Quelles sont les conclusions de l'étude UK Million Women Study sur l'hormonothérapie transdermique par rapport à l'hormonothérapie orale ?
- Quels sont les effets secondaires courants de l'utilisation du patch thermique médicamenteux ?Comprendre les risques et l'utilisation sûre
















