Les patchs transdermiques, y compris les patchs à micro-aiguilles (MNP), sont réglementés aux États-Unis en tant que produits combinés par la FDA, ce qui nécessite des processus d'approbation rigoureux pour garantir la sécurité et l'efficacité. Ces produits intègrent des dispositifs médicaux et des médicaments/composants biologiques, ce qui nécessite le respect de voies réglementaires spécifiques en fonction de leur mode d'action principal. Le processus d'approbation implique des tests précliniques et cliniques, un contrôle de la qualité et le respect des normes d'étiquetage et de fabrication.
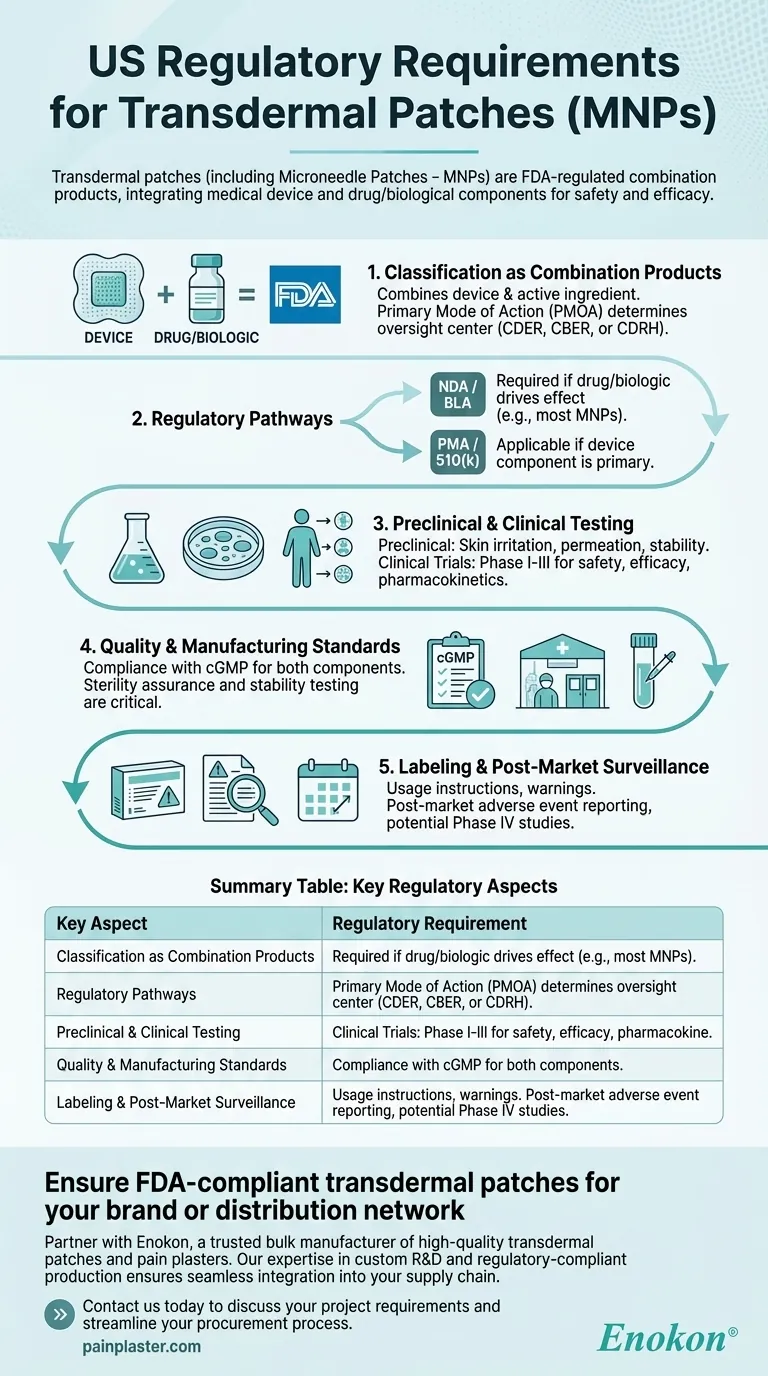
Explication des points clés :
-
Classification en tant que produits combinés
- La FDA classe les patchs transdermiques comme des produits combinés parce qu'ils associent un dispositif médical (par exemple, support de patch, micro-aiguilles) à un médicament ou à un ingrédient actif biologique.
- Le mode d'action principal (PMOA) détermine si le produit est réglementé par le Center for Drug Evaluation and Research (CDER), le Center for Biologics Evaluation and Research (CBER) ou le Center for Devices and Radiological Health (CDRH).
-
Voies réglementaires
- New Drug Application (NDA) ou Biologics License Application (BLA): Nécessaire si le médicament ou le composant biologique est à l'origine de l'effet thérapeutique.
- Approbation préalable à la mise sur le marché (PMA) ou 510(k): Applicable si le composant du dispositif est primaire (par exemple, des micro-aiguilles facilitant l'administration de médicaments).
- Les MNP suivent souvent la voie NDA/BLA en raison de leur fonction centrée sur le médicament.
-
Essais précliniques et cliniques
- Études précliniques: Elles comprennent des tests d'irritation cutanée, de perméation et de stabilité afin d'évaluer l'innocuité et l'efficacité de l'administration.
- Essais cliniques: Les essais de phase I-III évaluent la pharmacocinétique, l'efficacité et les effets indésirables chez l'homme.
-
Normes de qualité et de fabrication
- Conformité aux bonnes pratiques de fabrication actuelles (cGMP) pour les médicaments et les composants des dispositifs.
- L'assurance de la stérilité et les tests de stabilité sont essentiels pour les patchs de produits biologiques.
-
Étiquetage et surveillance post-commercialisation
- Les étiquettes doivent comporter des instructions d'utilisation, des avertissements et des conditions de stockage.
- Les exigences post-commercialisation comprennent la notification des effets indésirables et d'éventuelles études de phase IV.
Pour les acheteurs, la compréhension de ces exigences permet de s'aligner sur les fournisseurs conformes à la FDA, réduisant ainsi les risques de produits non conformes. Avez-vous réfléchi à l'impact de ces réglementations sur vos délais d'approvisionnement ou vos critères de sélection des fournisseurs ? L'interaction entre la surveillance des dispositifs et des médicaments façonne tranquillement la fiabilité des thérapies transdermiques modernes.
Tableau récapitulatif :
| Aspect clé | Exigence réglementaire |
|---|---|
| Classification | Réglementés par la FDA en tant que produits combinés (dispositif + médicament/biologique). |
| Mode d'action principal | Détermine la surveillance par le CDER (médicament), le CBER (produit biologique) ou le CDRH (dispositif). |
| Voies d'approbation | NDA/BLA (pour les médicaments) ou PMA/510(k) (pour les dispositifs). Les MNP suivent généralement la NDA/BLA. |
| Exigences en matière d'essais | Essais précliniques (sécurité, perméation) et cliniques (phases I-III). |
| Normes de fabrication | Conformité aux BPF pour les médicaments et les dispositifs ; garantie de stérilité pour les produits biologiques. |
| Obligations post-commercialisation | Déclaration des effets indésirables, études de phase IV et conformité de l'étiquetage. |
Garantir des patchs transdermiques conformes aux normes de la FDA pour votre marque ou votre réseau de distribution
Partenaire de
Enokon
Enokon est un fabricant de confiance de patchs transdermiques et de pansements analgésiques de haute qualité. Notre expertise en matière de R&D personnalisée et de production conforme aux réglementations garantit une intégration transparente dans votre chaîne d'approvisionnement.
Contactez-nous dès aujourd'hui pour discuter des exigences de votre projet et rationaliser votre chaîne d'approvisionnement.
pour discuter des exigences de votre projet et rationaliser votre processus d'approvisionnement.
Guide Visuel
Produits associés
- Patchs anti-douleur à chaleur infrarouge lointaine Patchs transdermiques
- Patchs chauffants anti-douleur pour les crampes menstruelles
- Patch Capsicum Heat Relief pour le soulagement des douleurs lombaires
- Patchs médicamenteux anti-douleur à la capsaïcine et au chili
- Patchs médicaux de gel réfrigérant pour la fièvre Patchs réfrigérants
Les gens demandent aussi
- Quels sont les types de douleur pour lesquels le patch dorsal de soulagement de la douleur par la chaleur profonde peut être utilisé ?Soulager naturellement les douleurs musculo-squelettiques
- Quelle est la rapidité d'activation du patch dorsal de soulagement de la douleur par la chaleur profonde et quelle est la durée de la chaleur qu'il procure ?Soulagement rapide et durable
- Quelles sont les principales caractéristiques du patch dorsal de soulagement de la douleur par la chaleur profonde ?Soulagement durable et sans médicament
- Comment fonctionne le patch dorsal de soulagement de la douleur par la chaleur profonde ?Soulagement de la douleur sans médicament grâce à la chaleur thérapeutique
- Les patchs thermiques peuvent-ils être utilisés pour les blessures récentes ?Pourquoi la thérapie par le froid est-elle plus efficace ?
















