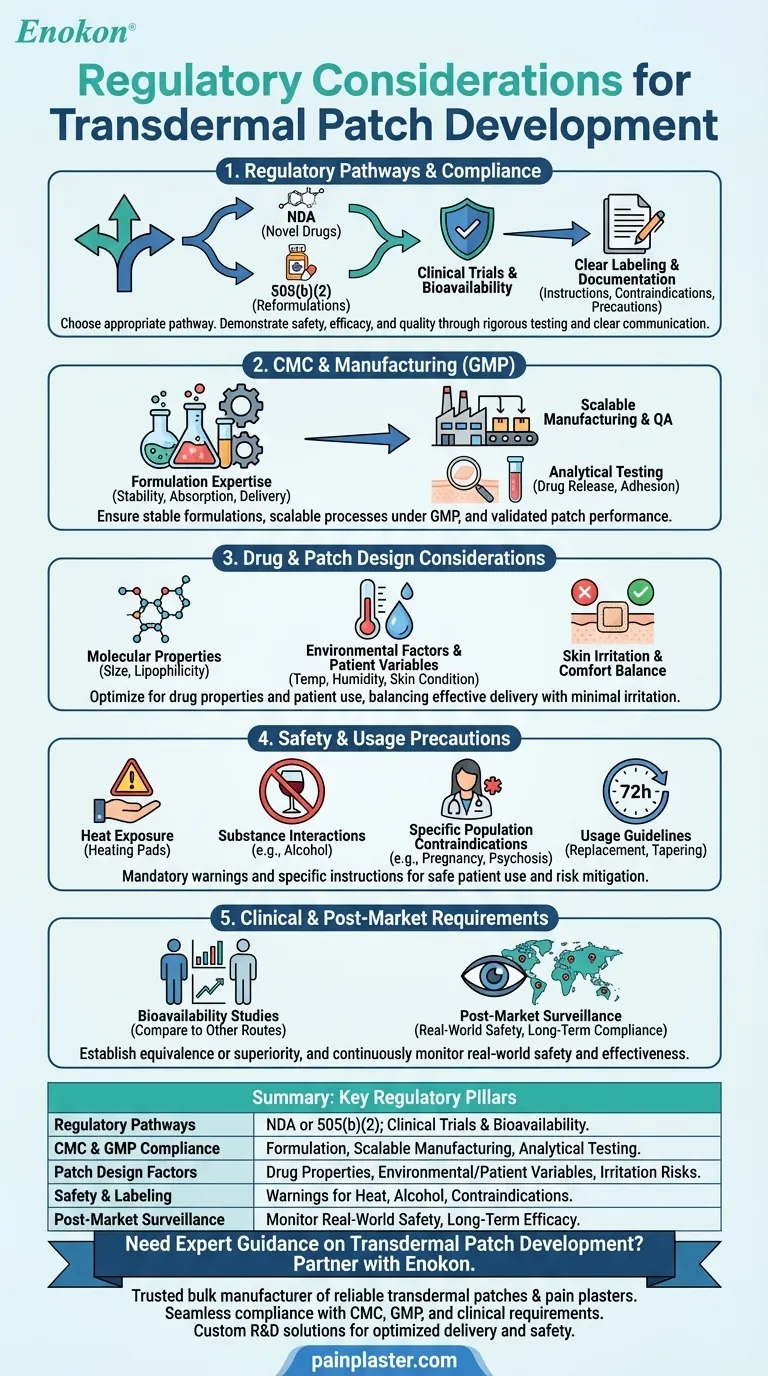
Le développement de patchs transdermiques implique de naviguer dans un paysage réglementaire complexe afin de garantir la sécurité, l'efficacité et la qualité.Les principaux éléments à prendre en compte sont la conformité aux exigences en matière de chimie, de fabrication et de contrôle (CMC), le respect des bonnes pratiques de fabrication (BPF) et la réalisation de tests cliniques approfondis pour vérifier la biodisponibilité et l'innocuité.La conception des patchs doit tenir compte des propriétés du médicament (taille moléculaire, polarité, etc.) et des facteurs environnementaux, tandis que l'étiquetage et la documentation doivent répondre à des normes strictes.Les voies réglementaires telles que les NDA ou 505(b)(2) peuvent s'appliquer, en fonction de la nouveauté du médicament.Des précautions telles que les risques d'irritation de la peau et les restrictions d'utilisation (par exemple, éviter l'exposition à la chaleur) doivent également être prises en compte pour obtenir l'approbation et garantir la sécurité des patients.

Explication des points clés :
-
Voies réglementaires et conformité
- Les promoteurs doivent choisir entre une demande de nouveau médicament (NDA) pour les nouveaux médicaments et la voie 505(b)(2) pour les reformulations de médicaments approuvés.
- La conformité des patchs transdermiques La réglementation exige que la sécurité, l'efficacité et la qualité soient démontrées par des essais cliniques, y compris des études de biodisponibilité.
- Un étiquetage et une documentation clairs sont obligatoires, détaillant les instructions d'utilisation, les contre-indications (par exemple, la psychose liée à la démence) et les précautions (par exemple, éviter l'alcool ou l'exposition à la chaleur).
-
Chimie, fabrication et contrôles (CMC)
- L'expertise en matière de formulation est essentielle pour garantir la stabilité et l'absorption des médicaments, ainsi que des taux d'administration cohérents.
- L'extensibilité et l'assurance qualité au cours de la fabrication commerciale doivent être conformes aux normes BPF.
- Les tests analytiques permettent de valider les performances des patchs, notamment les profils de libération des médicaments et les propriétés d'adhérence.
-
Considérations relatives à la conception du médicament et du timbre
- Les propriétés moléculaires (par exemple, petite taille, lipophilie) influencent les taux d'absorption et doivent être optimisées au cours du développement.
- Les facteurs environnementaux (température, humidité) et les variables propres au patient (état de la peau, âge) influent sur l'efficacité et doivent être testés dans des conditions réalistes.
- Les patchs doivent concilier l'administration du médicament et le confort, en minimisant l'irritation de la peau ou les réactions allergiques.
-
Précautions d'emploi et de sécurité
- L'étiquetage doit mettre en garde contre les risques tels que l'irritation de la peau, l'exposition à la chaleur (p. ex. coussins chauffants) et les interactions avec des substances telles que l'alcool.
- Des populations spécifiques (femmes enceintes ou allaitantes, personnes souffrant de psychose) peuvent nécessiter des contre-indications.
- Les directives d'utilisation (par exemple, remplacement toutes les 72 heures, protocoles de réduction progressive) doivent être clairement communiquées aux patients.
-
Exigences cliniques et post-commercialisation
- Les études de biodisponibilité comparent l'administration transdermique à d'autres voies (par exemple, la voie orale) pour établir l'équivalence ou la supériorité.
- La surveillance post-commercialisation permet de contrôler la sécurité dans le monde réel, de garantir l'observance à long terme et de traiter les effets indésirables imprévus.
En tenant compte de ces aspects, les développeurs peuvent surmonter les obstacles réglementaires tout en proposant des thérapies transdermiques efficaces et adaptées aux patients.Avez-vous réfléchi à la manière dont les adhésifs des patchs pourraient évoluer pour réduire l'irritation de la peau sans compromettre l'administration des médicaments ?
Tableau récapitulatif :
| Considérations réglementaires clés | Détails |
|---|---|
| Voies réglementaires | NDA pour les nouveaux médicaments ; 505(b)(2) pour les reformulations.Nécessite des essais cliniques et des études de biodisponibilité. |
| Conformité CMC et BPF | Stabilité de la formulation, fabrication évolutive et essais analytiques (libération de médicaments, adhérence). |
| Facteurs de conception des patchs | Optimiser les propriétés du médicament (taille, lipophilie), les variables environnementales/patient et les risques d'irritation de la peau. |
| Sécurité et étiquetage | Mettre en garde contre l'exposition à la chaleur, les interactions avec l'alcool et les contre-indications pour les populations à haut risque. |
| Surveillance post-commercialisation | Contrôler la sécurité dans le monde réel et l'efficacité à long terme après l'approbation. |
Besoin de conseils d'experts sur le développement de patchs transdermiques ? Partenaire de Enokon Enokon est un fabricant de confiance de patchs transdermiques et de pansements anti-douleur pour les marques de soins de santé et les distributeurs.Notre expertise technique garantit une conformité parfaite avec les exigences des CMC, des BPF et des tests cliniques, tandis que nos solutions R&D personnalisées optimisent l'administration des médicaments et la sécurité des patients. Contactez-nous dès aujourd'hui pour discuter de votre projet !
Guide Visuel
Produits associés
- Patchs anti-douleur à chaleur infrarouge lointaine Patchs transdermiques
- Patchs chauffants anti-douleur pour les crampes menstruelles
- Patch de protection des yeux à base de plantes Patch pour les yeux
- Patch anti-douleur au gel de menthol
- Patch anti-douleur Icy Hot Menthol Medicine
Les gens demandent aussi
- Comment le dispositif transdermique de granisétron doit-il être appliqué ?Étapes clés pour une utilisation sûre et efficace
- Quelles caractéristiques technologiques permettent aux patchs transdermiques d'asenapine d'atteindre une fréquence d'administration une fois par jour ?
- Comment appliquer et utiliser les patchs antidouleur ?Maximiser le confort et la sécurité grâce à des techniques appropriées
- Pourquoi une membrane de contrôle de débit est-elle essentielle dans la délivrance transdermique de médicaments ? Maîtrisez la précision dans la libération contrôlée
- Quels sont la classification et le mécanisme d'action du système transdermique Granisetron ?
- Quelles sont les principales différences dans les mécanismes de libération des médicaments entre les patchs transdermiques et les comprimés oraux ?
- Combien de temps un patch Deep Heat doit-il rester en place ?Conseils d'utilisation pour le soulagement de la douleur
- Quels sont les facteurs qui déterminent l'efficacité d'un analgésique topique ?Informations clés pour une prise en charge optimale de la douleur

















