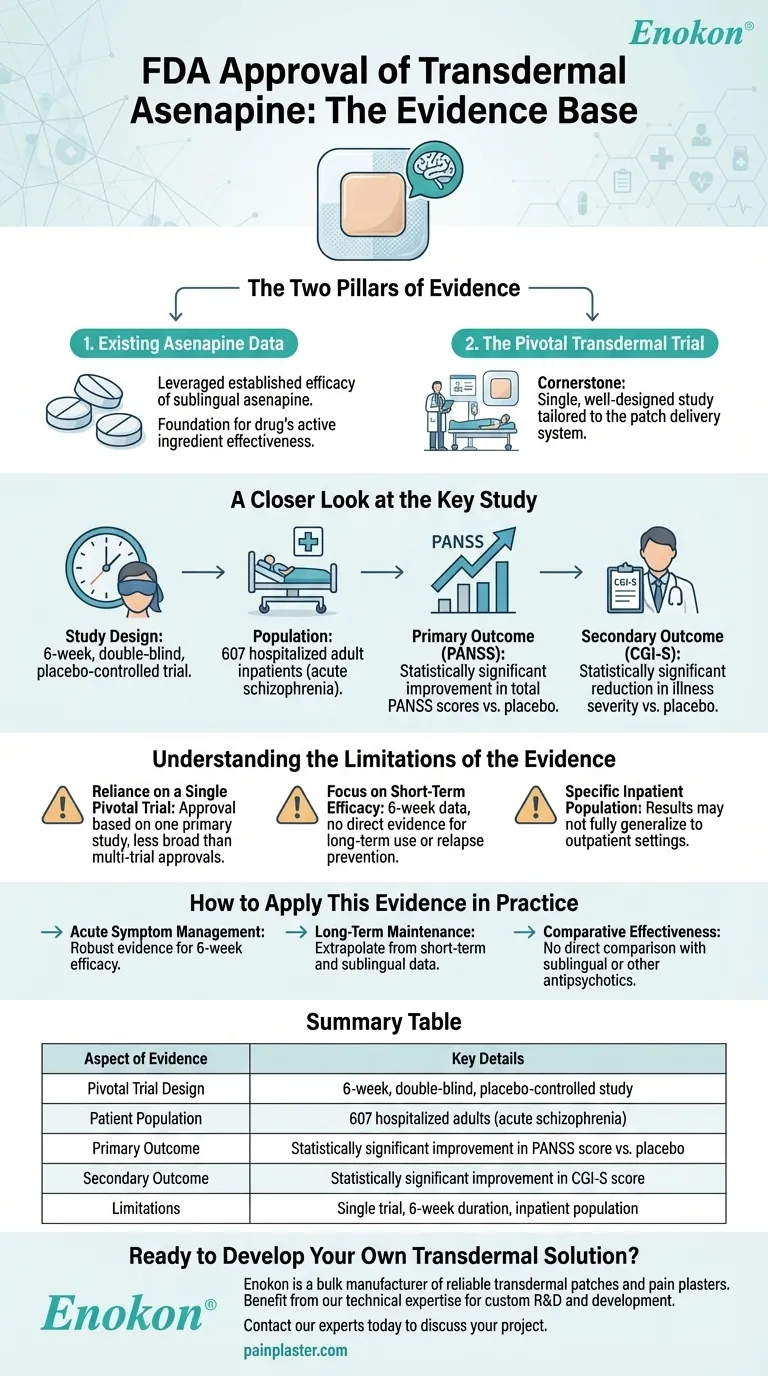
L'approbation par la FDA du patch d'asénapine (asénapine transdermique) a été étayé par une combinaison de données d'efficacité antérieures provenant d'études sur l'asénapine sublinguale et d'un essai pivot de 6 semaines, en double aveugle et contrôlé par placebo, portant sur 607 patients adultes hospitalisés atteints de schizophrénie.La formulation transdermique a démontré des améliorations statistiquement significatives des critères d'évaluation primaires (scores PANSS) et secondaires (évaluations CGI-S) par rapport au placebo, confirmant ainsi son bénéfice thérapeutique.L'ensemble de ces données a permis d'établir la sécurité, l'efficacité et la pertinence clinique du patch pour le traitement de la schizophrénie.
Explication des points clés :
-
Données antérieures sur l'efficacité de l'asénapine sublinguale
- Les essais antérieurs évaluant l'asénapine sublinguale ont fourni des preuves fondamentales du mécanisme d'action du médicament et de son potentiel thérapeutique dans la schizophrénie.
- Ces études ont probablement permis d'établir la posologie, les profils de sécurité et les résultats attendus pour la formulation transdermique, ce qui a simplifié le processus d'approbation.
-
Essai pivot de 6 semaines en double aveugle
- Conception de l'étude:Un essai rigoureux, contrôlé par placebo, portant sur 607 participants, a permis de garantir une puissance statistique solide et de minimiser les biais.
- La population:Axé sur les patients adultes hospitalisés souffrant de schizophrénie, reflétant la démographie cible pour l'utilisation clinique.
- Durée:Le délai de 6 semaines a permis d'équilibrer l'évaluation des symptômes aigus et l'applicabilité clinique pratique.
-
Critère d'évaluation principal :Scores PANSS
- L'échelle du syndrome positif et négatif (PANSS) est l'étalon-or pour évaluer la gravité des symptômes de la schizophrénie.
- Des améliorations statistiquement significatives des scores PANSS ont confirmé l'efficacité du patch dans la réduction des symptômes positifs (par exemple, hallucinations) et négatifs (par exemple, retrait social).
-
Critère d'évaluation secondaire :Échelle CGI-S
- L'échelle CGI-S (Clinical Global Impression-Severity) a permis de valider l'amélioration des symptômes rapportée par le clinicien.
- L'importance de cette échelle a renforcé les avantages cliniques observables et spécifiques au patient.
-
Sécurité et tolérance
- Bien qu'elle ne soit pas explicitement détaillée dans les références, l'approbation de la FDA implique que la formulation transdermique a satisfait aux critères d'innocuité, probablement en s'appuyant sur les données sublinguales et les rapports d'effets indésirables des nouveaux essais.
- L'administration transdermique peut présenter des avantages tels que la réduction des effets secondaires systémiques (par exemple, par rapport aux voies orales ou injectables).
-
Justification réglementaire
- La décision de la FDA reposait sur une efficacité reproductible (PANSS/CGI-S) et un profil risques-avantages clair, étayé par des données d'essais contrôlés.
- Les avantages du patch en termes de commodité et d'observance (par exemple, libération prolongée, voie non orale) peuvent avoir justifié davantage l'approbation pour une population souvent confrontée à des problèmes d'observance du traitement.
Pour les acheteurs de soins de santé, ces données soulignent l'importance de l'utilisation de l'asénapine. patch d'asénapine comme une option viable et étayée par des preuves pour la prise en charge de la schizophrénie, avec des avantages potentiels en termes d'administration et de tolérabilité.Son format transdermique correspondrait-il aux besoins de vos patients ou aux protocoles de votre établissement ?
Tableau récapitulatif :
| Preuves essentielles pour l'approbation de la FDA | Détails |
|---|---|
| Données antérieures sur l'asénapine sublinguale | Mécanisme d'action et profil de sécurité établis |
| Essai pivot de 6 semaines | 607 adultes schizophrènes hospitalisés, en double aveugle, contrôlés par placebo |
| Critère d'évaluation principal (scores PANSS) | Réduction statistiquement significative des symptômes |
| Critère d'évaluation secondaire (évaluations CGI-S) | Amélioration de la sévérité confirmée par le clinicien |
| Sécurité et tolérance | Répond aux critères de la FDA, avantages potentiels en matière d'observance |
| Justification réglementaire | Efficacité reproductible et profil risque-bénéfice clair |
Vous souhaitez intégrer l'asénapine transdermique dans vos protocoles de traitement ?
En tant que fabricant de confiance de patchs transdermiques et de pansements analgésiques, Enokon offre des solutions fiables et cliniquement validées pour les distributeurs de soins de santé et les marques pharmaceutiques.Notre expertise en R&D sur mesure garantit des formulations adaptées aux besoins de vos patients.
Contactez-nous dès aujourd'hui pour discuter des possibilités de partenariat ou demander des échantillons de produits.
Guide Visuel
Produits associés
- Patch contre la toux et la douleur de l'asthme pour adultes et enfants
- Patch anti-douleur au gel de menthol
- Patch anti-douleur Icy Hot Menthol Medicine
- Patches de soulagement de la chaleur profonde par infrarouge lointain Patches médicamenteux de soulagement de la douleur
- Patch de protection des yeux à base de plantes Patch pour les yeux
Les gens demandent aussi
- Comment fonctionne la technologie de l'infrarouge lointain dans le patch antitussif ?Découvrez un soulagement qui pénètre en profondeur
- Quel est le rôle des ingrédients naturels et de la stimulation des acupoints dans le patch antitussif ?Un soulagement à double action pour le bien-être respiratoire
- Qu'est-ce qui fait du patch antitussif une option pratique pour gérer la toux ?Un soulagement rapide et naturel sur le pouce
- Comment gérer l'oubli d'une dose de Reliever Patch ?Conseils d'utilisation en toute sécurité
- Comment la capsaïcine agit-elle dans le patch Reliever ?Une solution sans médicament pour un soulagement ciblé de la douleur















