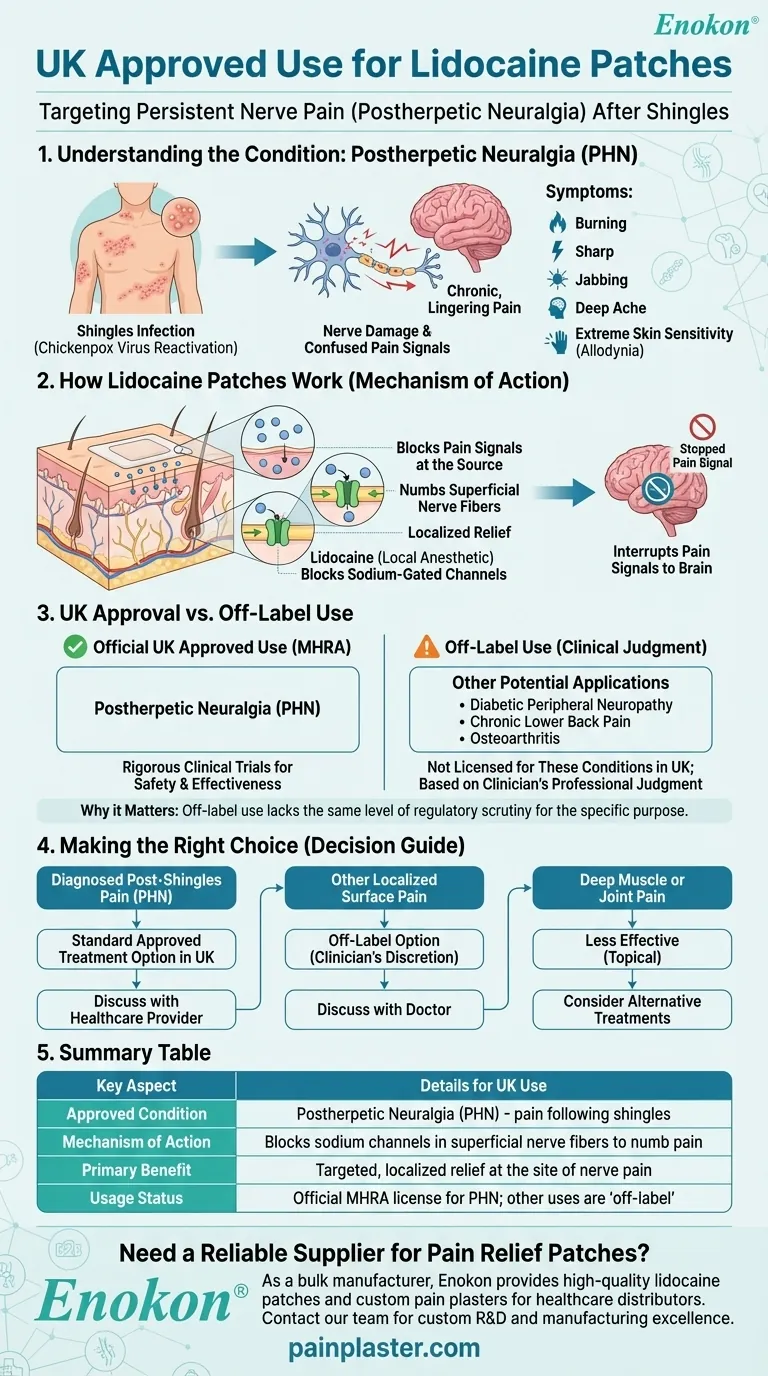
Au Royaume-Uni, patchs de lidocaïne sont spécifiquement approuvés pour le traitement de la névralgie post-zostérienne (NPZ), une douleur nerveuse persistante qui peut survenir après une infection par le zona.Bien que la recherche suggère des utilisations potentielles non indiquées pour d'autres douleurs, l'autorisation britannique est étroitement axée sur le traitement de la névralgie post-zostérienne.Cela diffère légèrement des approbations plus larges de la FDA, reflétant les distinctions réglementaires régionales dans les approches du traitement de la douleur.

Explication des points clés :
-
Principale indication approuvée au Royaume-Uni
- Les patchs de lidocaïne sont exclusivement approuvés pour la névralgie post-zostérienne (NPZ) au Royaume-Uni.
- La névralgie post-zostérienne est un syndrome douloureux neuropathique consécutif au zona, caractérisé par une douleur persistante dans les zones cutanées précédemment touchées.
-
Mécanisme d'action de la NPZ
- Les timbres administrent de la lidocaïne localisée (concentration de 5 %) pour bloquer les signaux nerveux anormaux dans les nerfs périphériques endommagés.
- L'application topique minimise l'absorption systémique, réduisant ainsi les effets secondaires par rapport aux analgésiques oraux.
-
Contexte réglementaire
- L'approbation britannique s'aligne sur le cadre de l'Agence européenne des médicaments (EMA), qui exige généralement des preuves cliniques solides pour des indications spécifiques.
- Contrairement à la FDA, les autorités de réglementation du Royaume-Uni et de l'Union européenne n'ont pas étendu l'autorisation à d'autres douleurs neuropathiques (par exemple, la neuropathie diabétique), malgré les recherches émergentes.
-
Considérations cliniques
- Les patchs sont appliqués directement sur la peau intacte, sur les zones douloureuses, jusqu'à 12 heures par jour.
- Les contre-indications comprennent l'hypersensibilité à la lidocaïne ou aux composants du patch.
-
Potentiel d'utilisation hors AMM
- Bien qu'il n'ait pas été approuvé au Royaume-Uni, des études font état de son efficacité dans l'arthrose, les douleurs dorsales chroniques et les douleurs post-chirurgicales.
- Les prescripteurs peuvent envisager une utilisation non indiquée sur l'étiquette en fonction des besoins individuels des patients et de l'évaluation des risques et des avantages.
-
Implications en matière d'achat
- Les achats de soins de santé doivent donner la priorité aux formulations vérifiées et approuvées par le Royaume-Uni pour le traitement de la NPZ.
- Pour la recherche ou les applications élargies, les protocoles institutionnels peuvent nécessiter une justification supplémentaire.
L'approbation ciblée du Royaume-Uni reflète une approche prudente de la gestion de la douleur neuropathique, mettant l'accent sur une utilisation fondée sur des données probantes pour la NPZ tout en reconnaissant un potentiel thérapeutique plus large grâce à la recherche en cours.
Tableau récapitulatif :
| Aspect clé | Détails |
|---|---|
| Condition approuvée | Névralgie post-zostérienne uniquement |
| Mécanisme d'action | Administration localisée de lidocaïne à 5 % pour bloquer les signaux nerveux anormaux. |
| Directives d'application | Appliquer sur la peau intacte pendant ≤12 heures/jour ; éviter les zones hypersensibles |
| Champ d'application réglementaire | Approbation alignée sur l'EMA (pas d'extension au Royaume-Uni pour d'autres douleurs neuropathiques) |
| Potentiel en dehors de l'étiquetage | Arthrose, douleurs dorsales chroniques (à la discrétion du prescripteur) |
Besoin de patchs de lidocaïne fiables pour le traitement des NPZ ? En tant que fabricant de confiance de solutions transdermiques de soulagement de la douleur, Enokon offre :
- Formulations conformes aux normes du Royaume-Uni pour la gestion de la névralgie post-zostérienne
- Soutien personnalisé en matière de R&D pour les distributeurs et les marques de soins de santé
- Production certifiée GMP garantissant une qualité et une efficacité constantes
Contactez notre équipe pour discuter de vos besoins en matière d'approvisionnement ou de développement dès aujourd'hui !
Guide Visuel
Produits associés
- Patch antidouleur en hydrogel de lidocaïne pour le soulagement de la douleur
- Patchs médicamenteux anti-douleur à la capsaïcine et au chili
- Patches de soulagement de la chaleur profonde par infrarouge lointain Patches médicamenteux de soulagement de la douleur
- Patch contre la toux et la douleur de l'asthme pour adultes et enfants
- Patchs chauffants anti-douleur pour les crampes menstruelles
Les gens demandent aussi
- Quels sont les symptômes de réaction allergique grave à surveiller avec la lidocaïne topique ?Reconnaître les signes de danger de mort
- Peut-on utiliser des patchs de lidocaïne en toute sécurité pendant l'allaitement ?Principales informations sur la sécurité pour les mères qui allaitent
- Comment conserver les dispositifs transdermiques de lidocaïne ?Lignes directrices essentielles pour la sécurité et l'efficacité
- Quels sont les effets secondaires courants mais moins graves qui peuvent survenir lors de l'utilisation topique de la lidocaïne ?Comprendre les réactions temporaires
- Quel a été le soulagement de la douleur signalé après le premier mois d'utilisation du plâtre ?Une prise en charge cohérente et efficace de la douleur
- Que se passe-t-il si un plâtre est laissé en place pendant plus de 12 heures ? Risques et bonnes pratiques
- Combien de temps faut-il pour que les pansements à la lidocaïne agissent ? Chronologie du soulagement et informations clés
- Quels sont les rapports de pharmacovigilance associés aux timbres transdermiques de lidocaïne ?Principaux effets indésirables et données de sécurité
















